Johns Hopkins Identifica Técnica Prometedora Para Diagnóstico De Alzheimer
12/10/2018
“Uno de los más grandes desafíos en el campo de la salud pública es la enfermedad de Alzheimer, para la que actualmente no existe cura ni tampoco un diagnóstico definitivo antes del momento de la autopsia”, señala el Dr. Dean Wong, M.D., Ph.D., catedrático de radiología y ciencias radiológicas, psiquiatría y ciencias conductuales, neurología y neurociencia, además de Director de Obtención de Imágenes Cerebrales por PET de Alta Resolución, en el Departamento de Medicina Nuclear de la Facultad de Medicina de la Universidad Johns Hopkins. “Hemos estado trabajando arduamente para identificar nuevos radiofármacos que puedan ayudar a acelerar el descubrimiento de diagnósticos y tratamientos para estos trastornos neurodegenerativos tan terribles.”
La enfermedad de Alzheimer se caracteriza por la aparición en el cerebro de dos estructuras proteicas anómalas: las placas amiloideas y las fibrillas entrelazadas compuestas de una proteína llamada tau. De acuerdo con el Dr. Wang, hasta ahora, uno de los grandes desafíos que se enfrentan al estudiar la enfermedad de Alzheimer es la imposibilidad de observar cómo estos llamados ovillos neurofibrilares se forman en tiempo real.
Como parte de un proyecto a más largo plazo financiado por F. Hoffman-La Roche, el equipo de científicos puso a prueba una colección de aproximadamente 550 posibles moléculas marcadoras e identificó seis marcadores que mostraban promesa, los cuales con el tiempo se redujeron a tres, que serían fabricados y puestos a prueba como candidatos a radiofármacos para PET de la proteína tau. Estos tres marcadores que mostraron mayor promesa se sometieron a pruebas previas en primates y los resultados se consideraron suficientemente favorables como para iniciar pruebas en humanos.
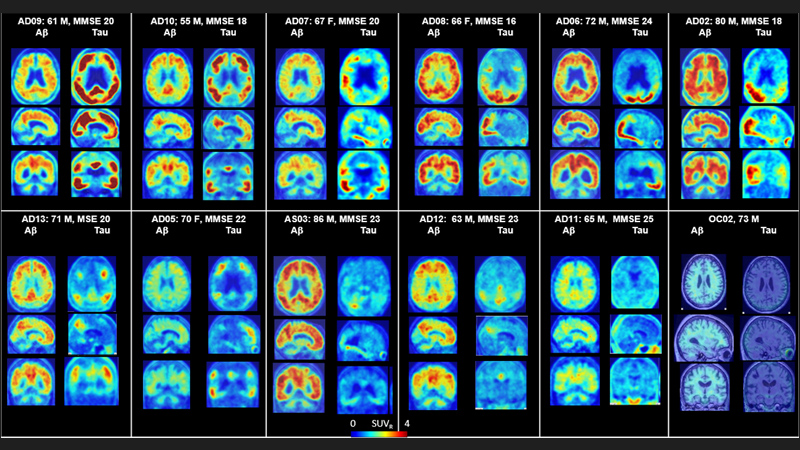
Los investigadores reclutaron en total 12 pacientes con enfermedad de Alzheimer, siete controles sanos más jóvenes (de 25 a 38 años de edad) y cinco controles sanos mayores (de 50 años o más de edad) para hacerles tomografías por emisión de positrones (PET) solo del cerebro. Adicionalmente, se reclutaron seis controles sanos mayores para hacerles tomografías de cuerpo entero. El estudio se dividió en tres partes. En la primera parte, a cada persona se le inyectó dos de los tres marcadores designados aleatoriamente (en visitas separadas) antes de hacerle las imágenes por PET, con la subsiguiente evaluación para determinar cuál molécula tuvo el mejor rendimiento. En la segunda parte del estudio, los investigadores pusieron a prueba el marcador óptimo, llamado F-18 RO948, con obtención adicional de imágenes del cerebro en cinco pacientes con Alzheimer y cinco controles mayores, haciendo luego un seguimiento a los pacientes con Alzheimer vistos previamente para evaluar la posible progresión del entrelazamiento de la proteína tau después de transcurrido un lapso promedio de aproximadamente 16 meses.
En la tercera parte del estudio se examinaron a los seis controles mayores a quienes se había hecho tomografías de todo el cuerpo. En total, los investigadores analizaron 80 diferentes regiones del cerebro para evaluar qué tan bien se habían acumulado los marcadores en el cerebro, qué tan bien penetraron a través del tejido y cómo específicamente se unieron a la proteína tau en lugar de tan solo pegarse indiscriminadamente a cualquier cosa. Las regiones cerebrales donde generalmente se acumula la proteína tau incluyen el lóbulo temporal, el lóbulo parietal y el lóbulo occipital, entre otras; se piensa que la materia gris en el cerebelo de los pacientes con Alzheimer contiene poca o ninguna concentración de la proteína tau. Lo que descubrieron fue que los cerebros sanos retuvieron poco o nada del marcador, mientras que en los cerebros de los pacientes con Alzheimer se observaba la proteína tau en regiones del cerebro que concordaban con los datos postmortem sobre los ovillos filamentosos que habían sido previamente informados.
En el segundo artículo, el equipo de investigadores examinó la cuantificación detallada de la unión de la proteína tau mediante el marcador F-18 RO948 en 11 pacientes con enfermedad de Alzheimer, cinco controles jóvenes cognoscitivamente normales y cinco controles mayores cognoscitivamente normales. Comprobaron que la cuantificación detallada del marcador puesto a prueba y vuelto a poner a prueba en aquellos cinco pacientes con Alzheimer y cinco controles mayores generó resultados confiables y reproducibles. Según el Dr. Wong, estos trabajos revelan que, en comparación con F-18 AV1451, el marcador de tau actualmente usado, el nuevo marcador F-18 RO948 no se une al azar a otros tejidos, lo cual ofrece mayor claridad en lo referente a la cuantificación de la posible concentración de la proteína tau dentro del cerebro humano.
“Realmente se necesita un ejército para hacer avanzar la investigación biomédica y este proyecto no ha sido la excepción, contamos con la participación del equipo de PET en Hopkins, con una organización de investigación que ayudó en el reclutamiento de participantes sanos, con los colegas de psiquiatría y ciencias conductuales, con los colegas en el Instituto Nacional sobre el Envejecimiento y con los neurocientíficos expertos en obtención de imágenes de Roche”, señala el Dr. Wong. “Este es un verdadero ejemplo de colaboración multidisciplinaria y me siento honrado de contar con tan excelentes colaboradores.”
